CBT LEONA VICARIO VILLA DEL CARBÓN
PROYECTO: TANTA AGUA Y YO CON SED
INTEGRANTES :
REYNA SANCHEZ SANTIAGO
JOSE ANTONIO PEREZ REYES
LUIS ENRIQUE GANTE JÍMENEZ
FÍSICA II
¿Cuáles son las propiedades del agua?
El agua no tiene color, sabor ni olor pero tiene propiedades químicas y físicas:
Propiedades químicas del agua
- La fórmula química del agua es H2O. Un átomo de oxígeno liga a dos átomos de hidrógeno. Los átomos de hidrógeno se "unen" a un lado del átomo de oxígeno, resultando en una molécula de agua, que tienen una carga eléctrica positiva en un lado y una carga negativa en el otro lado.
- Las moléculas de agua tienden a atraerse unas a otras, uniéndose. Esta es la razón del porqué se forman las gotas.
- Al agua se le llama el "solvente universal" porque disuelve más substancias que cualquier otro líquido. Esto significa que a donde vaya el agua, ya sea a través de la tierra o a través de nuestros cuerpos, lleva consigo valiosos químicos, minerales y nutrientes.
- El agua pura es neutral, significa que no es ácida ni básica. Propiedades físicas del agua
- El agua es la única substancia natural que se encuentra en sus tres estados -- líquida, sólida (hielo) y gaseosa (vapor) -- a las temperaturas encontradas normalmente en la Tierra
- El agua se congela a 0o grados Celsius (C) y hierve a 100o C (al nivel del mar). El agua en su forma sólida, hielo, es menos densa que en su forma líquida, por eso el hielo flota.
- El agua tiene un alto índice específico de calor. El agua puede absorber mucho calor antes de empezar a calentarse. También ayuda a regular el rango de cambio de la temperatura del aire, y ésta es la razón por la cual la temperatura cambia gradualmente durante las estaciones del año, especialmente cerca de los océanos.
- El agua tiene una tensión superficial muy alta. Esto significa que el agua es pegajosa y elástica y tiende a unirse en gotas. La tensión de la superficie es la responsable de que el agua pueda moverse (y disolver substancias) a través de las raíces de plantas y a través de los pequeños vasos sanguíneos en nuestros cuerpos.
Propiedades del aguaUsted puede tomar nuestra prueba de "falso-verdadero" acerca de las propiedades del agua. Algunas de las respuestas podrán sorprenderlo.¿Cuáles son las propiedades físicas y químicas del agua que la hacen tan singular y necesaria para todas las cosas vivas? El agua no tiene color, sabor ni olor. Pero las cualidades escondidas que tiene, la hacen un tema muy interesante. Las propiedades químicas del aguaCuando las moléculas de agua se atraen unas a otras, se unen. Esta es la razón del porqué se forman las gotas. Si no fuese por la gravedad de la Tierra, una gota de agua tendría forma redonda. |
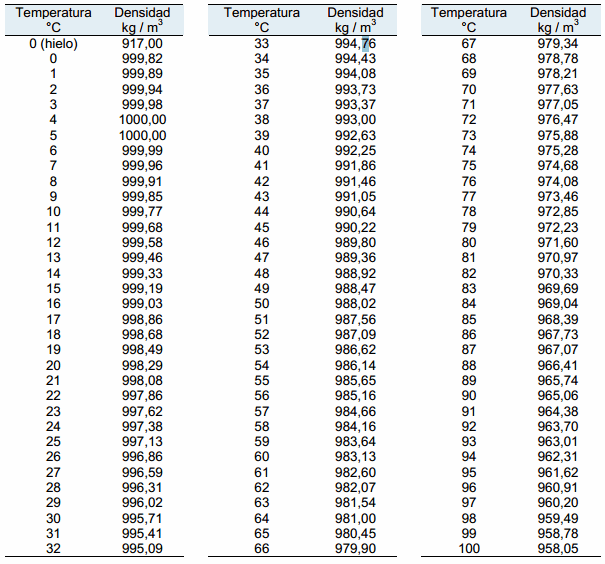
La densidad del agua es de 1 gr/cm3. Esto es a las siguientes condiciones:
- Presión = 1 Atm.
- Temperatura = 4°C

La densidad del agua expresado en diferentes unidades:
Densidad Agua = 1 gr/cm3 = 1000 Kg/m3 = 133.53 onza/galón = 62.43 Lb/ft3 = 0.04 Lb/pulg3
La densidad del agua es muy usada como patrón de densidades y volúmenes de otras sustancias y/o compuestos.
Una propiedad importante de la densidad del agua es que es muy estable, ya que esta varía muy poco a los cambios de presión y temperatura.
En esta tabla presentamos las densidades del agua a diferentes temperaturas, expresados en Kg/m3

 PARÁMETROS FÍSICO-QUÍMICOS: ALCALINIDAD
DEFINIMOS ALCALINIDAD COMO :
PARÁMETROS FÍSICO-QUÍMICOS: ALCALINIDAD
DEFINIMOS ALCALINIDAD COMO :La capacidad del agua para neutralizar ácidos o aceptar protones. Esta representa la suma de la bases que pueden ser tituladas en una muestra de agua. Dado que la alcalinidad de aguas superficiales está determinada generalmente por el contenido de carbonatos, bicarbonatos e hidróxidos, ésta se toma como un indicador de dichas especies iónicas. No obstante, algunas sales de ácidos débiles como boratos, silicatos, nitratos y fosfatos pueden también contribuir a la alcalinidad de estar también presentes. Estos iones negativos en solución están comúnmente asociados o pareados con iones positivos de calcio, magnesio, potasio, sodio y otros cationes. El bicarbonato constituye la forma química de mayor contribución a la alcalinidad. Dicha especie iónica y el hidróxido son particularmente importantes cuando hay gran actividad fotosintética de algas o cuando hay descargas industriales en un cuerpo de agua. La alcalinidad, no sólo representa el principal sistema amortiguador del agua dulce, sino que también desempeña un rol principal en la productividad de cuerpos de agua naturales, sirviendo como una fuente de reserva para la fotosíntesis. Históricamente, la alcalinidad ha sido utilizada como un indicador de la productividad de lagos, donde niveles de alcalinidad altos indicarían una productividad alta y viceversa (Tabla 1). Dicha correlación se debe en parte a que la disponibilidad del carbono es mayor en lagos alcalinos y también al hecho de que las rocas sedimentarias que contienen carbonatos, a menudo contienen también concentraciones relativamente altas de nitrógeno y fósforo PARAMETROS FISICO-QUIMICOS: ALCALINIDAD 2 (en comparación con el granito, otras rocas ígneas y regiones donde el lecho rocoso ha sido desgastado y lavado, los cuales generalmente contienen bajas concentraciones de estos dos nutrientes limitantes y del CaCO3).
Después de la formación de los óxidos correspondientes tanto metálicos como no metálicos, es factible combinarlos con agua para formar nuevos compuestos. En el caso de los óxidos metálicos cuando interactúan con agua forman hidróxidos. Retomando el ejemplo del magnesio, se observa lo siguiente.
El óxido de magnesio en presencia de agua forma el hidróxido de magnesio.
Los óxidos no metálicos en presencia de agua forman ácidos del tipo oxiácido.
Por ejemplo en el dióxido de carbono o anhídrido carbónico al reaccionar con agua, produce una molécula de ácido carbónico.
Observa que sólo se suman la cantidad de elementos que intervienen en la síntesis de los ácidos, empezando por la calidad ácido representado por los hidrógenos, después el no metal y finalmente la cantidad de oxígenos que intervienen en la esquematización simbólica de la reacción para formar ácidos.